Когда мы думаем о технологическом прогрессе и развитии, аккумуляторы, вероятно, не являются самыми увлекательными объектами для разговора. Тем не менее, устройство и работа свинцово-кислотных аккумуляторов продолжают оставаться тайной для многих людей. Возможно, потому что они уже стали нечто обыденным, где-то глубоко запрятанным внутри наших машин и гаджетов.
Однако, свинцово-кислотные аккумуляторы имеют фундаментальное значение для функционирования широкого спектра устройств. Они действуют как источник электроэнергии, обеспечивая бесперебойное питание. Будь то автомобили, солнечные батареи или внешние батареи для зарядки мобильных устройств, свинцово-кислотные аккумуляторы являются надежным и эффективным выбором.
Секрет эффективности аккумуляторов кроется в их химической структуре и внутреннем устройстве. Хотя точные детали могут отличаться в зависимости от конкретной модели или производителя, все свинцово-кислотные аккумуляторы имеют общие принципы работы. Знание этих принципов может помочь нам понять, как они способны предоставлять электрическую энергию в таком удивительно компактном устройстве.
Состав и принцип действия аккумулятора на основе свинца и кислоты
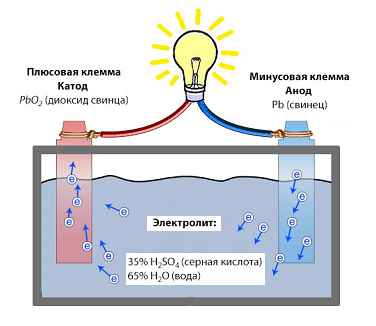
В аккумуляторе присутствует специальный контейнер, который содержит несколько отдельных ячеек, образующих элементы аккумулятора. В каждой ячейке находятся электроды и электролит, которые обеспечивают хранение и высвобождение электрической энергии.
- Правый электрод, содержащий свинец, называется анодом. Он проводит электроны во время разряда аккумулятора.
- Левый электрод, наличие которого связано с присутствием кислотного электролита, называется катодом. Он принимает электроны при разряде аккумулятора.
- Электролит, состоящий из различных кислотных растворов, обеспечивает передачу ионообмена между анодом и катодом.
При зарядке аккумулятора, на аноде происходит окисление свинца, образуя ионы свинца и свободные электроны. Ионы свинца перемещаются через электролит и поглощаются катодом. При этом свободные электроны передаются по внешней цепи, что порождает электрический ток.
Во время разряда аккумулятора, процесс протекает в обратном направлении. Ионы свинца возвращаются на анод, а свободные электроны переходят на катод через внешнюю цепь, обеспечивая поставку электроэнергии для устройства, которое питается аккумулятором.
Анод и катод
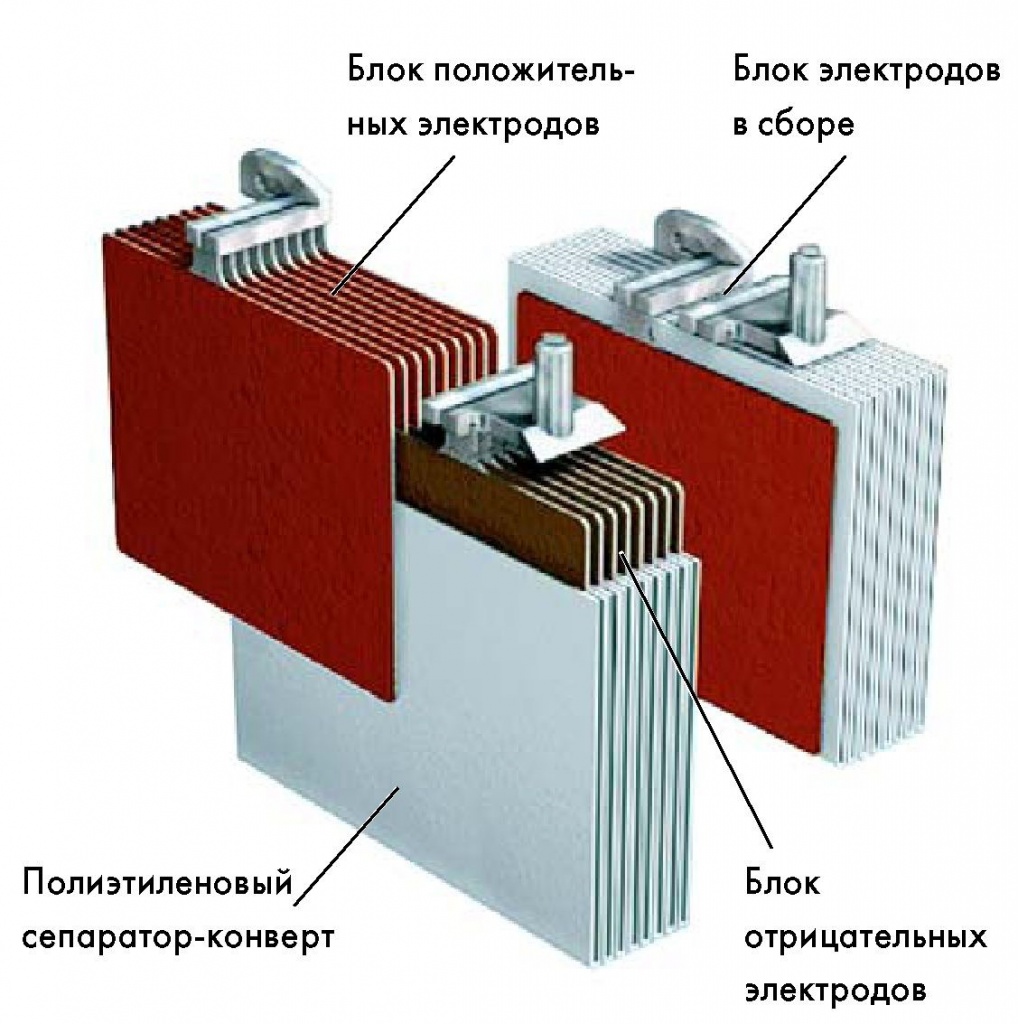
Анод — это положительно заряженный электрод, на котором происходит окислительная реакция, во время которой положительные ионы свинца оставляют электрод и перемещаются по электролиту к катоду. Активный веществом для анода обычно служит свинец или его сплавы.
Катод, напротив, является отрицательно заряженным электродом, на котором происходит восстановительная реакция. Здесь положительные ионы свинца поглощаются катодом, происходит восстановление активного вещества катода, обычно оксида свинца. Благодаря этой реакции аккумулятор может снова быть использован для будущих циклов зарядки и разрядки.
| Анод | Катод |
|---|---|
| Положительно заряженный электрод | Отрицательно заряженный электрод |
| Окислительная реакция | Восстановительная реакция |
| Положительные ионы свинца покидают анод | Положительные ионы свинца поглощаются катодом |
| Содержит активное вещество — свинец или его сплавы | Содержит активное вещество — оксид свинца |
Электролит и сульфат свинца
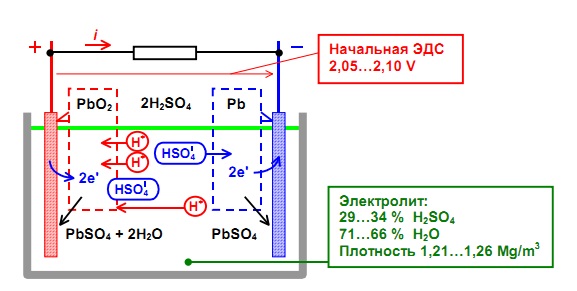
Сульфат свинца – это неорганическое соединение, обладающее способностью растворяться в воде. Оно состоит из аниона сульфата (SO42-) и катиона свинца (Pb2+), которые образуют стабильную реакцию ионного обмена с водой. В процессе разряда аккумулятора, сульфат свинца разлагается на ионы свинца и ионы сульфата. При зарядке, эта реакция происходит в обратном направлении, и ионы свинца и сульфата проходят обратно через электролит и соединяются, восстанавливая исходное соединение.
Электролит с сульфатом свинца обеспечивает электрическую связь между двумя электродами аккумулятора, а также участвует в химических реакциях, которые происходят во время работы аккумулятора. Благодаря своим свойствам, сульфат свинца обеспечивает устойчивую работу аккумулятора и его высокую эффективность в хранении и выдаче электрической энергии.
Работа аккумулятора при зарядке и разрядке
Процесс зарядки аккумулятора происходит путем подвода электрического тока к аккумулятору через внешний источник энергии, такой как зарядное устройство или генератор. При этом происходит обратимая химическая реакция внутри аккумулятора, которая преобразует отрицательно заряженные и положительно заряженные элементы аккумулятора в связанные химические соединения.
Когда аккумулятор используется для разрядки, химические реакции внутри него начинают превращать химическую энергию в электрическую энергию. В этом процессе освобождается электрический ток, который может быть использован для питания электрических устройств, таких как фонари, автомобили или мобильные телефоны.
Во время разрядки аккумулятора положительно заряженные и отрицательно заряженные элементы аккумулятора находятся в контакте между собой через электролит, что позволяет электронам перемещаться внутри аккумулятора и создавать электрический ток. Этот ток подается на устройство, которое питается от аккумулятора.
Таким образом, при зарядке аккумулятор преобразует электрическую энергию в химическую энергию, которая сохраняется для будущего использования, а при разрядке эта химическая энергия превращается обратно в электрическую энергию, которая питает устройство. Разрядка аккумулятора може происходить множество раз, пока его химические компоненты не перестанут выполнять свою функцию.
Зарядка и процесс электролиза
В данном разделе мы рассмотрим процесс зарядки свинцово-кислотного аккумулятора и его связь с электролизом.
| Этапы зарядки | Описание |
|---|---|
| 1. Подготовка | На данном этапе аккумулятор приводится в рабочее состояние перед зарядкой. Для этого проверяется его техническое состояние и уровень электролита. |
| 2. Подключение | Аккумулятор подключается к источнику постоянного тока, обычно используется автоматическое зарядное устройство, которое контролирует процесс зарядки. |
| 3. Зарядка | При подключении аккумулятора к источнику тока происходит разложение воды на кислород и водород, а также обратная реакция, при которой происходит ионизация электролита и образуются свинцовые сульфаты. В результате этих процессов электроды аккумулятора восстанавливают свою емкость. |
| 4. Отключение | При достижении определенного уровня заряда аккумулятор отключается от источника тока для предотвращения перезарядки, что может привести к повреждению аккумулятора. |
Таким образом, процесс зарядки свинцово-кислотного аккумулятора связан с выполнением электролиза, который происходит во время подключения аккумулятора к источнику тока. Эти процессы взаимодействуют друг с другом и позволяют аккумулятору восстанавливать свою емкость и готовиться к последующему использованию.
Разрядка и реакция обратного процесса
В данном разделе рассмотрим процесс разрядки свинцово-кислотного аккумулятора и его обратную реакцию. Когда аккумулятор используется для питания различных устройств, происходит разрядка, при которой аккумулятор отдает свою энергию для питания электроники.
Во время разрядки происходит химическая реакция между свинцовыми пластинами в аккумуляторе и электролитом, что приводит к образованию свинца(II) оксида на поверхности пластин. Этот процесс сопровождается высвобождением электронов, которые направляются через внешний цепь для предоставления энергии. Таким образом, разрядка аккумулятора является электрохимической реакцией.
После использования аккумулятора его энергетический запас истощается, и наступает необходимость его повторной зарядки. В процессе зарядки происходит обратная реакция: свинец(II) оксид на пластинах аккумулятора окисляется обратно в свинец, а электроны, подаваемые через внешнюю цепь, используются для преобразования электролита и восстановления энергии аккумулятора.
Таким образом, свинцово-кислотный аккумулятор обладает способностью к электрохимическому циклу зарядки и разрядки, что позволяет использовать его в различных электронных устройствах для обеспечения непрерывного питания.